Defensin
Defensiner er forsvarsmolekyler, der spiller en central rolle i forsvaret mod patogener, og de går under forskellige navne som antimikrobielle peptider, AMP, og host defense peptides, HDP (se også nedenfor).
Defensiner er en vigtig del af immunsystemet (det innate immunsystem, det medfødte immunsystem). Defensiner findes i dyr, planter og svampe. Evolutionært er beta-defensinerne de ældste defensiner, der kan spores mere end 150 millioner år tilbage.
Defensinerne findes i immunceller, for eksempel i neutrofile granulocytter og næsten alle epithelceller, i tarmceller, i modermælk m.m.
Defensinerne er små cysteinrige, kationiske proteiner (positivt ladede), der er aktive mod mikroorganismer, bakterier, svampe og virus. De består af 18-45 aminosyrer, herunder seks (hos hvirveldyr) til otte bevarede cysteiner, der danner tre eller fire cystinbroer, dannende et kompakt molekyle med en velbevaret struktur. De fleste defensiner virker ved at binde sig til den mikrobielle cellemembran og danne porer (huller), der tillader udstrømning af cellens indre, bl.a. essentielle ioner og næringsstoffer.[1]
Funktion
[redigér | rediger kildetekst]Defensiner er kationiske og kan derfor reagere med membranen på invaderende mikrober, som er negative på grund af lipopolysaccharider (LPS) og lipoteichsyre (LTA) i cellemembranen. Peptiderne har højere affinitet til mikrobemembranen sammenlignet med Ca2+ og Mg2+ ioner. Disse ioner vil derfor blive udskiftet med defensiner, hviklet påvirker membranens stabilitet. Peptiderne har en større størrelse sammenlignet med de ioner, der forårsager ændringer i membranstrukturen. På grund af ændringer i det elektriske potentiale og peptidernes hydrofobicitet, vil peptiderne indlejre sig i membranen som dimerer, der danner en pore. Dannelsen af porer vil forårsage en depolarisering af membranen og en lyse af cellen.
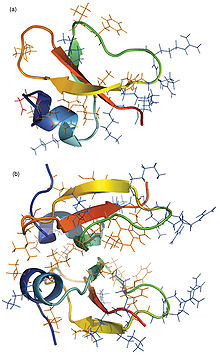
Molekylstruktur
[redigér | rediger kildetekst]Defensinerne er små cysteinrige kationiske peptider (små proteiner) bestående af 18-45 aminosyrer.
Det gennemgående motiv i defensinerne er bevarede cystinbroer: tre cystinbroer hos hvirveldyr og fire cystinbroer hos hvirvelløse dyr, planter, svampe og bakterier.
Benævnelsen defensin synes at definere to peptid-familier baseret på deres funktion som et molekylært forsvar og på deres strukturelle ligheder. Defensinerne synes også at forekomme i alle levende organismer, idet defensinerne i hvirvelløse dyr, planter og svampe danner en evolutionært beslægtet gruppe, og alle defensinerne i hvirveldyr danner en anden evolutionært beslægtet gruppe. Disse to grupper kan være fylogenetisk beslægtede gennem en tidlig prokaryotisk stamform, jf. forekomsten af defensin-lignende molekyler i bakterier.
De underliggende gener, der er ansvarlige for defensinproduktion, er stærkt polymorfe. Nogle aspekter bevares dog; kendetegnene for et defensin er dets lille størrelse, høj densitet af kationisk ladning og seks til otte cysteiner. Generelt kodes de af to exons, hvor den første exon koder for en hydrofob ledersekvens og den anden for en sekvens med cysteinmotivet. Alle defensiner har disulfidbindinger. Disulfidbindingerne er blevet foreslået at være essentielle for aktiviteter relateret til medfødt immunitet hos pattedyr
Henvisninger
[redigér | rediger kildetekst]
- ANTIMIKROBIELLE PEPTIDER. Biotech Academy Arkiveret 28. maj 2019 hos Wayback Machine
