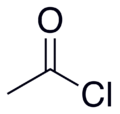
Acetylklorid
| Acetylklorid | |||
|---|---|---|---|
 | |||
 | |||
| IUPAC-navn Acetylklorid | |||
| Generelt | |||
| Systematisk navn | Ethanoylklorid | ||
| Andre navne | Acylklorid | ||
| Molekylformel | CH3COCl | ||
| Molarmasse | 78,49 g/mol | ||
| Fremtræden | Farveløs væske | ||
| CAS-nummer | |||
| SMILES | ClC(=O)C | ||
| InChI | 1/C2H3ClO/c1-2(3)4/h1H3 | ||
| Kemiske egenskaber | |||
| Massefylde | 1,104 g/ml (l) | ||
| Opløselighed i vand | Reagerer med vand | ||
| Smeltepunkt | -112 °C (161 K) | ||
| Kogepunkt | 52 °C (325 K) | ||
| Struktur | |||
| Dipolmoment | 2,45 D | ||
| Sikkerhed | |||
| EU klassifikation | Brændbar (F) Ætsende (C) | ||
| NFPA 704 | |||
| R-sætninger | R11 R14 R34 | ||
| S-sætninger | S1/2 S9 S16 S26 S45 | ||
| Flammepunkt | 4 °C (277 K) | ||
| Selvantændelses-temperatur | 390 °C (663 K) | ||
| Explosionsgrænser | 7,3–19 % | ||
| Beslægtede stoffer | |||
| Andre acylklorider | Propionylklorid Butyrylklorid | ||
| Relaterede forbindelser | Eddikesyre Eddikesyreanhydrid Acetylbromid | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
Acetylklorid (CH3COCl) er acylkloridet af eddikesyre. Det hører til acylhaliderne, en klasse af organiske forbindelser. Det fremtræder som en farveløs, ætsende, flygtig væske.
Syntese
[redigér | rediger kildetekst]Acetylklorid blev første gang syntetiseret i 1852 af den franske kemiker Charles Frédéric Gerhardt ved reaktion mellem kaliumacetat (CH3COO−+K+) og fosforylklorid (POCl3).[1]
Ved reaktion mellem eddikesyreanhydrid og hydrogenklorid dannes en blanding af acetylklorid og eddikesyre:[2]
- (CH3CO)2O + HCl → CH3COCl + CH3CO2H
Laboratoriesyntese
[redigér | rediger kildetekst]I laboratoriet syntetiseres acetylklorid ved reaktion mellem eddikesyre og vandsugende kloreringsreagenser som fosfortriklorid (PCl3), fosforpentaklorid (PCl5), sulfurylklorid (SO2Cl2) eller thionylklorid (SOCl2). Produktet af disse reaktioner er dog typisk forurenet med fosfor- eller svovlholdige urenheder, som kan besværliggøre efterfølgende reaktioner.[3] En alternativ syntese, der ikke danner fosfor- og svovlholdige urenheder, består i at reagere fosgen med eddikesyre:
- COCl2 + CH3COOH → CH3COCl + HCl + CO2
HCl-urenheder kan fjernes ved efterfølgende destillation af råproduktet fra dimethylanilin eller ved at gennemboble blandingen med en strøm af argon.
Andre metoder
[redigér | rediger kildetekst]En blanding af dikloreddikesyre (CHCl2COOH) og eddikesyre danner acetylklorid ved opvarmning.[3] Acetylklorid kan tillige dannes ved katalytisk carbonylering af metylklorid (CH3Cl).[4]
Forekomst
[redigér | rediger kildetekst]Acetylklorid forventes ikke at forekomme i naturen, idet kontakt med vand vil hydrolysere acetylklorid til eddikesyre og hydrogenklorid. Selv i atmosfærisk luft frigiver acetylklorid hvide "dampe" som følge af hydrolyse forårsaget af fugt i luften. Disse dampe er i virkeligheden små dråber af saltsyre (HCl i vandig opløsning) og eddikesyre dannet ved hydrolyse.
Anvendelser
[redigér | rediger kildetekst]I organisk syntese anvendes acetylklorid til acyleringsreaktioner, dvs. indførelsen af en acetylgruppe. Acetyl er en acylgruppe med formlen -C(=O)-CH3. To vigtige typer acyleringsreaktioner er esterificering og Friedel-Crafts-acylering.
Eddikesyreestre og -amider
[redigér | rediger kildetekst]Acetylklorid anvendes som reagens i syntesen af estre og amider af eddikesyre. Ved reaktion mellem f.eks. acetylklorid og ætanol dannes esteren ethylacetat:
- CH3COCl + HO-CH2-CH3 → CH3-COO-CH2-CH3 + H-Cl
Acyleringsreaktioner af denne type udføres ofte i tilstedeværelse af en base som pyridin, triethylamin eller 4-dimethylaminopyridin, der dels fungerer som katalysator, dels neutraliserer det dannede HCl. Disse reaktioner foregå ofte via dannelsen af en midlertidig keten.
Friedel-Crafts-acyleringer
[redigér | rediger kildetekst]En anden vigtig type acyleringsreaktion er Friedel-Crafts-acyleringen,[5] der er et eksempel på en elektrofil aromatisk substitution.
Referencer
[redigér | rediger kildetekst]- ^ Se:
- Gerhardt, Charles (1852) "Ueber wasserfreie organische Säuren" (Om vandfri organiske syrer), Annalen der Chemie und Pharmacie, 83 : 112–116. (tysk)
- Gerhardt, Charles (1853) "Untersuchungen über die wasserfreien organischen Säuren" (Undersøgelser af vandfri organiske syrer), Annalen der Chemie und Pharmacie, 87 : 57–84 ; se især pp. 68–71. (tysk)
- ^ Hosea Cheung, Robin S. Tanke, G. Paul Torrence. “Acetic Acid”, artikel i Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. . (engelsk)
- ^ a b Leo A. Paquette (2005). "Acetyl chloride". Handbook of Reagents for Organic Synthesis, Activating Agents and Protective Groups (engelsk). John Wiley & Sons. s. 16. ISBN 978-0-471-97927-2.
- ^ US patent 4352761 (Webside ikke længere tilgængelig) (besøgt 20. august 2016). (engelsk)
- ^ Charles Merritt, Jr and Charles E. Braun "9-Acetylanthracene" Org. Synth. 1950, 30, 2. (engelsk)
Eksterne henvisninger
[redigér | rediger kildetekst]- International Chemical Safety Card 0210 (engelsk)