Lithium
| Lithium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sølvagtigt, hvidt/gråt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Li | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 1 (Alkalimetal) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 3028194 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 6,940±0,060 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 145 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-radius | 182 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 1s² 2s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | +1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 0,98 (Paulings skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | Fast stof | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk, I-centreret | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (fast stof) | 0,534 g/cm³ (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (væske) | 0,512 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 453,69 K (180,54 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | 1603 K (1330 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | (Ekstrapoleret) 2949 °C, 67 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | 3,00 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 136 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | 3482 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 85 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeudvidelseskoeff. | 46 µm/(m·K) (25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mekaniske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forskydningsmodul | 4,2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Mohs' skala) | 0,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Information med symbolet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lithium eller litium (fra græsk: λίθος lithos, "sten") er et grundstof med symbolet Li og atomnummeret 3. Det er et blødt, sølv-hvidt metal tilhørende gruppen af alkalimetaller i det periodiske system. Ved standardbetingelser er det det letteste metal og det faste grundstof med mindst massefylde. Lithium er, som alle alkalimetaller, stærkt reaktivt og brændbart, og af denne grund opbevares det normalt i mineralolie. Når det skæres åbent, udviser det en metallisk glans, men ved kontakt med fugtig luft korroderer overfladen hurtigt til en mat, sølvgrå farve og senere falmet sort. På grund af dets høje reaktivitet forekommer lithium aldrig frit i naturen, men i stedet kun i forbindelser, som normalt er ioniske. Lithium forekommer i en række pegmatitiske mineraler, men på grund af dets opløselighed som en ion er det til stede i havvand og udvindes typisk fra saltlager og ler. På kommercielt niveau isoleres lithium elektrolytisk fra en blanding af lithiumklorid og kaliumklorid.
Lithiums kerne er på kanten af ustabilitet, da de to stabile lithiumisotoper, der er blevet fundet i naturen, har nogle af de laveste bindingsenergier pr. nukleon ud af alle stabile nuklider. På grund af dets relative nukleare ustabilitet er lithium mindre almindeligt i solsystemet end 25 ud af de første 32 grundstoffer, selvom dets atomkerner har en meget lav atomvægt.[1] Af lignende grunde har lithium flere vigtige anvendelser indenfor atomfysik. Lithiumatomers transmutation til helium i 1932 var den første fuldt menneskeskabte kernereaktion, og lithium-6-deuterid er fusionsbrændsel i visse typer termonukleare våben.[2]
Lithium og dets forbindelser har forskellige industrielle anvendelser, såsom varmeresistent glas og keramik, lithiumsæbe, flux til jern-, stål- og aluminiumproduktion, lithiumbatterier og lithium-ion-batterier. Disse sektorer står til sammen for anvendelsen af mere end tre fjerdedele af al den lithium, der produceres.
Spormængder af lithium findes i alle organismer. Grundstoffet tjener tilsyneladende ingen livsvigtig biologisk funktion, da dyr og planter fint kan overleve uden det, men det er dog ikke blevet endeligt udelukket, at lithium kunne tjene mindre, uvæsentlige funktioner. Nogle undersøgelser har peget i retning af, at lithium kan være et essentielt sporstof,[3] og at det kan medvirke til at forlænge menneskers liv.[4] Lithium-ionen Li+, anvendt som en af flere lithiumsalte, har vist sig at være en effektiv humørstabilisator ved behandling af bipolar affektiv sindslidelse hos mennesker.
Egenskaber
[redigér | rediger kildetekst]Atomiske og fysiske
[redigér | rediger kildetekst]Ligesom de andre alkalimetaller har lithium en enkelt valenselektron, der nemt opgives til dannelse af en kation.[5] Dette faktum gør lithium til en god leder af både varme og elektricitet såvel som et stærkt reaktivt grundstof, selvom det dog er det mindst reaktive alkalimetal. Lithiums lave reaktivitet skyldes dets valenselektrons nærhed til dets kerne (de tilbageværende to elektroner er i 1s-kredsløb ved meget lavere energi og medvirker ikke til kemiske bindinger).[5]
Lithiummetal er blødt nok til at kunne skæres med en kniv. Når det skæres ud, får det en sølvhvid farve, der hurtigt ændres til grå efterhånden, som det oxiderer til lithiumoxid.[5] Selvom det har et af de laveste smeltepunkter af alle metaller (180 °C), er det dog stadig det alkalimetal med højest smelte- og kogepunkt.[6]
Lithium har en meget lav massefylde (0,534 g/cm3) sammenligneligt med fyrretræ. Det er det mindst fyldige af alle de grundstoffer, der har fast form ved rumtemperatur; det næst-letteste faste grundstof (kalium, på 0,862 g/cm3) har mere end 60 % større massefylde. Bortset fra helium og hydrogen har det derudover mindre massefylde end noget flydende grundstof, idet dets massefylde er blot 2/3 af flydende kvælstofs (0,808 g/cm3).[7] Lithium kan flyde på de letteste hydrocarbon-olier og er et af kun tre metaller, der kan flyde på vand (de to andre er alkalimetallerne natrium og kalium).

Lithiums termiske ekspansionskoefficient er det dobbelte af aluminiums og næsten fire gange så stor som jerns.[8] Lithium er superledende under 400 μK ved standardtryk[9] og ved højere temperaturer (mere end 9 K) ved mere højt tryk (>20 GPa).[10] Ved temperaturer under 70 K gennemår lithium, ligesom natrium, diffusionsløse faseforandrende transformationer. Ved 4,2 K har det et rhombohedralt krystalsystem; ved højere temperaturer transformeres det til en kubisk rumcentreret krystalstruktur. Ved flydende-helium-temperaturer (4 K) er den rhombohedrale struktur oftest forekommende.[11] Der er fundet flere allotropiske lithiumformer ved højt tryk.[12]
Lithium har en masse-specifik varmekapacitet på 3,58 kilojoules pr. kilogram-kelvin, hvilket er det højeste ud af alle faste grundstoffer.[13][14] Af denne grund anvendes lithiummetal ofte i forbindelse med afkøling ved forskellige typer varmeoverførsel.[13]
Kemi og forbindelser
[redigér | rediger kildetekst]Lithium reagerer nemt med vand, men med betydeligt mindre energi end andre alkalimetaller. Reaktionen danner hydrogengas og lithiumhydroxid i vandig opløsning.[5] På grund af dets reaktivitet med vand opbevares lithium normalt forsegnet med hydrocarbon - ofte vaseline. Selvom de tungere alkalimetaller kan opbevares i stoffer med større massefylde, såsom mineralolier, er lithiums massefylde ikke stor nok til, at det kan nedsænkes fuldstændigt i disse væsker.[15] I fugtig luft får lithium hurtigt et sort lag af lithiumhydroxid (LiOH og LiOH·H2O), lithiumnitrid (Li3N) og lithiumcarbonat (Li2CO3, resultatet af en sekundær reaktion mellem LiOH og CO2).[16]

Når de placeres over en flamme, vil lithiumforbindelser afgive en bemærkelsesværdig blodrød farve, men når det brænder stærkt, vil flammen blive klart sølvfarvet. Lithium vil antænde og brænde i oxygen, når det udsættes for vand eller vanddampe.[17] Lithium er brændbart og potentielt eksplosivt, når det udsættes for luft og især vand, selvom dette dog er til en mindre grad, end det er tilfældet med de andre alkalimetaller. Lithium-vand-reaktionen er ved normale temperaturer livlig, men dog mild, da den producerede hydrogen ikke antænder af sig selv. Som det er tilfældet med alle alkalimetaller, er lithiumbrande svære at udslukke, og der behøves normalt klasse D-pulverslukkere. Lithium er det eneste metal, der reagerer med nitrogen ved normale tilstande.[18][19]
Lithium har et diagonalt forhold med magnesium, et grundstof med lignende atom- og ionradius. Blandt de kemiske ligheder mellem de to metaller er også dannelsen af et nitrid ved reaktion med N2, dannelsen af et oxid (Li2O) og peroxid (Li2O2), når det brændes i O2, salte med lignende opløseligheder, samt carbonaterne og nitridernes termiske ustabilitet.[16][20] Metallet reagerer med hydrogengas ved høje temperaturer, hvor det producerer lithiumhydrid (LiH).[21]
Blandt andre kendte binære forbindelser er halogenider (LiF, LiCl, LiBr, LiI), sulfid (Li2S), superoxid (LiO2) og carbid (Li2C2). Der kendes også mange andre uorganiske forbindelser, hvori lithium kombinerer med anioner og danner salte: borater, amider, carbonater, nitrater eller borohydrid (LiBH4). Lithiumaluminiumhydrid (LiAlH4) bruges ofte som et reduktionsmiddel ved organisk syntese.
Mange lithiumorganiske reagenser vides at have direkte bindinger mellem carbon- og lithiumatom, hvor de reelt skaber en carbanion. Disse er ekstremt kraftfulde baser og nukleofiler. I mange af disse lithiumorganiske forbindelser har lithiumionerne en tendens til at samle sig i høj-symmetriske klynger for sig selv, hvilket er relativt normal opførsel blandt alkalikationer.[22] LiHe, en meget svagt interagerende van der Waals-forbindelse, er blevet identificeret ved meget lave temperaturer.[23]
Isotoper
[redigér | rediger kildetekst]Naturligt forekommende lithium består af to stabile isotoper, 6Li og 7Li, hvoraf den sidste er hyppigst forekommende (92,5 % af den naturlige forekomst).[5][15][24] Begge de naturlige isotoper har abnormt lav kernefysisk bindingsenergi pr. nukleon (sammenlignet med de nærliggende grundstoffer i det periodiske system, helium og beryllium); lithium er det eneste grundstof med lavt nummer, der kan producere nettoenergi gennem kernefission. De to lithiumkerner har lavere bindingsenergi pr. nukleon end nogen anden stabil nuklid, bortset fra deuterium og helium-3.[25] Som resultat af dette er lithium, på trods af sin meget lette atomvægt, mindre almindeligt i Solsystemet end 25 af de første 32 grundstoffer.[1] Syv radioisotoper er blevet beskrevet, hvoraf de mest stabile er 8Li med en halveringstid på 838 ms og 9Li med en halveringstid på 178 ms. Alle de tilbageværende radioaktive isotoper har halveringstider, der er kortere end 8,6 ms. Den mest kortlivede lithiumisitio er 4Li, som henfalder gennem protonemission og har en halveringstid på 7,6 × 10−23 s.[26]
7Li er et urgrundstof (eller rettere, urnuklider), der blev produceret ved Big Bang-nukleosyntese. En lille mængde af både 6Li og 7Li produceres i stjerner, men menes at blive "brændt" lige så hurtigt som det produceres.[27] Yderligere små mængder lithium af både 6Li og 7Li kan genereres fra solvind, kosmisk stråling, der rammer tungere atomer, og fra radioaktivt henfald af 7Be og 10Be fra det tidlige solsystem.[28] 7Li kan også genereres i carbonstjerner.[29]
Lithiumisotoper fraktionerer betragteligt i en lang række naturlige processer,[30] heriblandt mineralformation (kemisk udfældning), metabolisme og ionudveksling. Lithiumioner substituerer for magnesium og jern i oktaedriske steder i lermineraler, hvor 6Li foretrækkes frem for 7Li, hvilket resulterer i berigelse af den lette isotop ved hyperfiltrering og klippeforandring. Den eksotiske 11Li vides at udvise en nuklear glorie. En proces kendt som Atomic vapor laser isotope separation (forkortet "ALVIS") kan bruges til at separere lithiumisotoper, især 7Li fra 6Li.[31]
Atomvåbenmanufaktur og andre atomfysiske anvendelser er en stor kilde til kunstig lithiumfraktionering, hvor den lette isotop 6Li opbevares i industrielle og militære lagerbeholdninger i en sådan grad, at det har medført en lille, men målbar forandring i mængdeforholdet mellem 6Li og 7Li i naturlige kilder, såsom floder. Dette har ført til en usædvanlig usikkerhed omkring lithiums standardiserede atomvægt, siden denne kvantitet afhænger af den naturlige forekomst af de naturligt forekommende lithiumisotoper.[32]
Forekomst
[redigér | rediger kildetekst]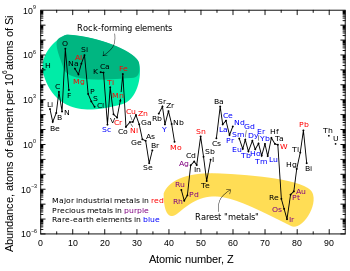
I rummet
[redigér | rediger kildetekst]Ifølge moderne kosmologisk teori var lithium — i form af begge stabile isotoper (lithium-6 og lithium-7) — et af de 3 grundstoffer, der blev syntetiseret i Big Bang.[33] Selvom mængden af lithium, der blev genereret i Big Bang-nukleosyntese, afhænger af antallet af fotoner pr. baryon, kan lithiummængden udregnes ud fra de accepterede værdier, og der er herigennem fundet en "kosmologisk lithiumdiskrepans" i universet: ældre stjerner lader til at indeholde mindre lithium, end de burde, og nogle yngre stjerner har meget mere. Manglen på lithium i ældre stjerner skyldes tilsyneladende "blandingen" af lithium ind i stjernernes indre, hvor det bliver ødelagt,[34] mens lithium derimod produceres i yngre stjerner. Selvom det forvandles til to heliumatomer pga. kollision med en proton ved temperaturer på mere end 2,4 millioner grader Celsius (en temperatur som de fleste stjerner nemt kan opnå i deres indre), forekommer lithium oftere i stjerner af yngre dato end de fleste moderne beregninger ellers forudsiger.[15]

Selvom det var et af de tre første grundstoffer, der blev syntetiseret i Big Bang, er lithium, sammen med beryllium og bor, betydeligt mindre udbredt end andre grundstoffer. Dette skyldes de lave temperaturer, der skal til for at ødelægge lithium, såvel som en mangel på almindelige processer til at producere det.[36]
Lithium findes også i brune dværge og bestemte anormale orange stjerner. Dets tilstedeværelse i stjernernes spektre kan bruges i "lithiumtesten" til at differentiere mellem brune og røde dværge, idet lithium er til stede i de kølige brune dværge, men ødelægges i de varmere røde dværge.[15][37][38] Visse orange stjerner kan også indeholde en høj koncentration af lithium. De orange stjerner, der har en usædvanligt høj lithiumkoncentration (såsom Centaurus X-4), er i kredsløb omkring massive objekter — neutronstjerner eller sorte huller — hvis tyngdekraft tilsyneladende trækker tungere lithium til overfladen på en hydrogen-helium-stjerne, hvilket gør at mere lithium kan observeres.[15]
På Jorden
[redigér | rediger kildetekst]| Land | Produktion | Reserver[note 1] |
|---|---|---|
| 3.800 | 2.000.000 | |
| 13.400 | 1.500.000 | |
| 160 | 48.000 | |
| 480 | 180.000 | |
| 11.700 | 7.500.000 | |
| 2.200 | 3.200.000 | |
| 300 | 60.000 | |
| 900 | 23.000 | |
| Verden samlet | 32.500 | 14.000.000 |
Selvom lithium distribueres omfattende på Jorden, forekommer det ikke naturligt i sin grundstofform på grund af dets høje reaktivitet.[5] Havvands overordnede lithiumindhold vurderes til gengæld at være meget højt, på omkring 230 milliarder ton, hvor grundstoffet eksisterer i en relativt konstant koncentration på 0,14 til 0,25 ppm,[40][41] or 25 micromolar;[42] med højere koncentrationer nær hydrotermiske væld (op til 7 ppm).[41]
Vurderingerne af lithiumindholdet i Jordens skorpe går fra 20 til 70 ppm efter vægt.[16] I overensstemmelse med sit navn udgør lithium en mindre del af magmatiske bjergarter, hvoraf den største koncentration er i granit. Granitisk pegmatitter udgør også den største forekomst af lithium-indeholdende mineraler, hvoraf spodumen og petalit er de mest kommercielt tilgængelige kilder.[16] Et andet vigtigt lithiummineral er lepidolit.[43] En nyere kilde til lithium er hectorit, som i øjeblikket kun aktivt udvindes af Western Lithium Corporation i USA.[44] Med 20 mg lithium prr kg af Jordens skorpe[45] er lithium det 25. mest forekommende grundstof. Skønt lithium findes i mange sten og nogle saltlage, er det et relativt sjældent grundstof, da det normalt kun findes i meget små koncentrationer. Der findes således relativt mange lithiummineral-depoter i jorden, men meget få af dem er af potentiel kommerciel værdi. Mange er meget små eller af for ringe kvalitet.[46]
US Geological Survey vurderede i 2010, at Chile havde langt de største lithiumreserver (7,5 millioner ton)[47] og den største årlige produktion (8.800 ton). En af de største lithium-"reservebaser"[note 1] er Salar de Uyuni-områder i Bolivia, som har 5,4 millioner ton. Blandt andre store leverandører er Australien, Argentina og Kina.[39][48]
I juni 2010 rapporterede New York Times, at amerikanske geologer gennemførte jordundersøgelser på udtørrede saltsøer i det vestlige Afghanistan, da man mente, at der befandt sig en stor lithiumaflejring der. Ansatte hos Pentagon fortalte i den forbindelse, at deres oprindelige analyse af en lokation i Ghazni-provinsen viste potentiale for lithiumaflejringer på størrelse med Bolivias.[49] Disse estimater er hovedsageligt baseret på gamle data, som blev indsamlet af Sovjetunionen under besættelsen af Afghanistan i perioden 1979–1989. Stephen Peters, chef for USGS's Afghanistan Minerals Project, udtalte, at han ikke var opmærksom på USGS-involvering i nogle nye mineralundersøgelser i Afghanistan.[50]
I biologien
[redigér | rediger kildetekst]Lithium findes i spormængder i mange planter, plankton og hvirvelløse dyr, i koncentrationer af 69 til 5.760 ppb. Koncentrationen er lidt mindre i hvirveldyr, og næsten alle hvirveldyrs væv og kropsvæsker indeholder lithium på et niveau fra 21 til 763 ppb.[41] Marine organismer har en tendens til at bioakkumulere mere lithium end jordbaserede organismer.[51] Det er uvist, hvorvidt lithium har en fysiologisk rolle i nogle af disse organismer,[41] men ernæringsstudier hos pattedyr indikerer en vis vigtighed for helbredet og en klassifikation som essentielt sporstof med en anbefalet daglig tilførsel på omkring 1 mg/dag.[3] Observationsstudier i Japan rapporterede i 2011, at naturligt forekommende lithium i drikkevand kan forlænge menneskers liv.[4]
Historie
[redigér | rediger kildetekst]
Petalit (LiAlSi4O10) blev opdaget i 1800 af den brasilianske kemiker og statsmand José Bonifácio de Andrada e Silva i en mine på øen Utö i Sverige.[52][53][54][55] Det var dog først i 1817 Johan August Arfwedson, der arbejdede i laboratoriet hos kemikeren Jöns Jakob Berzelius, opdagede tilstedeværelsen af et nyt grundstof, mens han analyserede petalitmalm.[56][57][58][59] Dette grundstof dannede forbindelser meget lig natriums og kaliums, selvom dets carbonat og hydroxid var mindre vandopløselige og mere alkaliske.[60] Berzelius gav det alkaliske materiale navnet "lithion/lithina", fra det græske ord λιθoς (translittereret som lithos, betydende "sten"), for at reflektere dets opdagelse i et fast mineral, i modsætning til kalium, som var blevet opdaget i planteaske, og natrium, som delvist var kendt for sin rigelige forekomst i dyreblod. Han navngav metallet i materialet "lithium".[5][54][59]
Arfwedson påviste senere, at dette samme grundstof var til stede i mineralerne spodumen og lepidolit.[54] I 1818 var Christian Gmelin den første til at bemærke, at lithiumsalte giver en flamme en tydelig rød farve.[54][61] Både Arfwedson og Gmelin forsøgte (og fejlede i) at isolere det rene grundstof fra dets salte.[54][59][62] Det blev ikke isoleret før 1821, da William Thomas Brande udvandt det ved elektrolyse af lithiumoxid i en proces, der tidligere var blevet anvendt af kemikeren Sir Humphry Davy til at isolere alkalimetallerne kalium og natrium.[15][62][63][64][65] Brande beskrev også nogle rene lithiumsalte, såsom dets klorid, og vurderede lithiums atomvægt til at være på omkring 9,8 g/mol (moderne værdi ~6,94 g/mol), idet han vurderede, at lithia (lithiumoxid) indeholdt omkring 55 % metal.[66] I 1855 blev større mængder lithium produceret gennem elektrolyse af lithiumklorid af Robert Bunsen og Augustus Matthiessen.[54][67] Opdagelsen af denne procedure førte til, at det tyske selskab Metallgesellschaft AG i 1923 påbegyndte en kommerciel lithiumproduktion ved at foretage elektrolyse af en flydende blanding af lithiumklorid og kaliumklorid.[54][68][69]
Produktionen og anvendelsen af lithium har gennemgået flere drastiske forandringer igennem historien. Den første store anvendelse af lithium var som høj-temperaturs lithiumfedt til flymotorer og lignende anvendelse under og efter anden verdenskrig. Denne brug blev blandt andet udbredt pga. det faktum, at lithium-baseret sæbe har et højere smeltepunkt end andre alkaliske sæber og er mindre korrosiv end calcium-baserede sæber. Leverandørerne til det lille marked for lithiumsæber og lithiumfedt var for det meste små mineoperationer, hovedsageligt i USA.
Efterspørgslen efter lithium voksede betragteligt under den kolde krig i takt med produktionen af kernefusionsvåben. Både lithium-6 og lithium-7 producerer tritium, når de bestråles med neutroner, og er derfor nyttige til produktionen af tritium, såvel som som fast fusionsbrændstof til brug inde i hydrogenbomber i form af lithiumdeuterid. USA blev verdens ledende lithiumproducent i perioden mellem slutningen af 1950'erne og midten af 1980'erne. Til sidst nåede lithiumlageret omkring 42.000 ton lithiumhydroxid. Det lagrede lithium blev udtømt i lithium-6 med 75 %, hvilket var nok til at påvirke lithiums målte atomvægt i mange standardiserede kemikalier og selv lithiums atomvægt i nogle "naturlige kilder" til lithiumion, som var blevet "forurenet" af lithiumsalte udledt fra isotopseperationsfaciliteter, der var havnet i grundvandet.[32][70]
Lithium blev brugt til at sænke glas' smeltetemperatur og til at forbedre aluminiumoxids smelteadfærd ved brug af Hall-Héroult-processen.[71][72] Disse to anvendelser dominerede lithiummarkedet frem til midten af 1990'erne. Efter slutningen på atomkapløbet sank efterspørgslen efter lithium, og det amerikanske energiministerium begyndte at sælge ud af deres lithiumlager på det åbne marked, hvilket drev prisen yderligere ned.[70] I midten af 1990'erne begyndte flere virksomheder dog at udvinde lithium fra saltlage, hvilket viste sig at være en billigere metode end minedrift i undergrunden. De fleste af minerne lukkede eller skiftede fokus til andre materialer, da kun malmen fra udlagt pegmatit kunne udvindes til en konkurrencedygtig pris. For eksempel lukkede de amerikanske miner nær Kings Mountain, North Carolina, før årtusindeskiftet.
I det nye årtusinde øgede udviklingen af lithium-ion-batterier pludselig efterspørgslen efter lithium, og i 2007 blev det den altdominerende anvendelse af grundstoffet.[73] I kølvandet på den nye eksplosion i efterspørgsel udvidede nye virksomheder deres udvinding fra saltlage.[74][75]
Produktion
[redigér | rediger kildetekst]
Lithiumproduktionen er steget betragteligt siden anden verdenskrig. Metallet separeres fra andre grundstoffer i magmatiske mineraler. Lithiumsalte udvindes fra vand i mineralkilder og saltlagepøle og -aflejringer. Metallet produceres gennem elektrolyse fra en blanding af smeltet 55 % lithiumklorid og 45 % kaliumklorid ved omkring 450 °C.[76] I 1998 lå prisen omkring 95 USD/kg.[77]
Reserver
[redigér | rediger kildetekst]De identificerede lithiumreserver blev i 2008 af US Geological Survey (USGS) vurderet til på verdensplan at indeholde 13 millioner ton,[39] selvom det dog er svært at måle lithiumreserver præcist.[78][79]
Der findes aflejringer i Andesbjergene i Sydamerika. Chile er den førende producent, fulgt af Argentina. Begge lande udvinder lithium fra saltlagspøle. I USA udvindes lithium hovedsageligt fra saltlagspøle i Nevada.[13] Halvdelen af verdens kendte reserver ligger dog i Bolivia, langs Andesbjergenes centrale østlige side. I 2009 forhandlede Bolivia med japanske, franske og koreanske virksomheder omkring at påbegynde udvikling.[80] Ifølge USGS indeholder Bolivias Uyuni-ørken 5,4 millioner tons lithium.[80][81] En nyligt opdaget aflejring i Wyoming's Rock Springs Uplift vurderes at indeholde 228.000 ton. Det er blevet ekstrapoleret frem til, at yderligere aflejringer i samme klippeformation kan indeholde op til 18 millioner ton.[82]
Der er uenighed omkring vækstpotentialet. Et studie fra 2008 konkluderede, at realistisk opnåelig lithiumcarbonat-produktion vil kun række til en lille fraktion af fremtidig efterspørgsel på det globale PHEV- og EV-marked, at efterspørgsel fra den transportable elektronik-sektor vil absorbere meget af de planlagte produktionsstiginger i det næste årti, at masseproduktion af lithiumcarbonat ikke er miljømæssigt forsvarligt og vil forårsage uoprettelig økologisk skade på økosystemer, samt at liion-fremdriftssystemer er uforenelige med idéen om en 'grøn bil'.[48]
Omvendt fandt et studie fra Lawrence Berkeley National Laboratory og University of California, Berkeley i 2011, at den nuværende vurderede reservebase af lithium ikke bør være en begrænsende faktor for batteriproduktion til elkøretøjer på stor skala, da man burde kunne bygge omkring 1 milliard 40 kWh Li-baserede batteier med de nuværende reserver[83] - omkring 10 kg lithium pr. bil.[84] Et andet studie fra forskere fra University of Michigan og Ford Motor Company i 2011 fandt, at der findes tilstrækkelige ressourcer til at understøtte global efterspørgsel frem til 2100, inklusive den lithium, der kræves til potentielt udbredt brug i transportsektoren. Studiet vurderede, at der på globalt plan findes 39 millioner ton lithimreserver, og at den samlede lithiumefterspørgsel i den 90-år-lange analyserede periode blev vurderet til 12-20 millioner ton afhængig af scenarierne vedrørende økonomisk vækst og genbrugsrater.[85]
9. juni 2014 skrev Financialist, at lithiumefterspørgslen voksede med mere end 12 % om året; ifølge Credit Suisse overstiger denne rate den forventede tilgængelighed med 25 %. Udgivelsen sammenlignede lithiumsituationen anno 2014 med olie, hvor "højere oliepriser ansporede investering i dyre dybvands- og oliesands-produktionsteknikker"; det vil sige at prisen på lithium vil fortsætte med at stige indtil dyrere produktionsmetoder, der kan styrke det samlede output, kan vinde investorernes opmærksomhed.[86]
Prissætning
[redigér | rediger kildetekst]Efter Finanskrisen i 2007 droppede store leverandører såsom Sociedad Química y Minera (SQM) prisen på lithiumcarbonat med 20 %.[87] Priserne steg igen i 2012. En Business Week-artikel i 2012 beskrev oligopolet, der hersker indenfor lithiumproduktion: "SQM, kontrolleret af milliardæren Julio Ponce, er de næststørste, fulgt af Rockwood, som støttes af Henry Kravis’s KKR & Co., og Philadelphia-baserede FMC". Globalt forbrug kan komme op på 300.000 ton om året i 2020, fra omkring 150.000 ton i 2012, hvis man skal kunne matche efterspørgslen efter lithiumbatterier, der er vokset med omkring 25 % om året, og har overhalet den overordnede stigning i lithium på 4-5 %.[88]
Kilder
[redigér | rediger kildetekst]Geotermiske brønde
[redigér | rediger kildetekst]En potentiel kilde er geotermiske brønde. Geotermiske væsker transporterer perkolat til overfladen;[89] generhvervelse af lithium er blevet demonstreret i feltet.[90] Lithium separeres ved simpel filtrering. Processen og miljømæssige omkostninger stammer hovedsageligt fra den allerede-eksisterende brønd, og nettopåvirkningen af miljøet kan således være positiv.[91]
Havvand
[redigér | rediger kildetekst]Lithium er til stede i havvand, men praktiske udvindingsteknikker er endnu ikke blevet kommercialiserede.[92]
Udvinding
[redigér | rediger kildetekst]Saltlagsfordampning
[redigér | rediger kildetekst]Pr. 2015 sker størstedelen af verdens lithiumproduktion i Sydamerika, hvor saltlage indeholdende lithium udvindes fra underjordiske pøle og koncentreret fordampning via Solen. I 2010 blev Simbol Materials bevilliget $3 millioner fra det amerikanske energiministerium til et pilotprojekt, der skulle vise, hvorvidt udvinding af højkvalitets-lithium fra geotermiske saltlage er finansielt gennemførligt. Projektet anvender saltlage fra de 49,9-megawatt geotermiske kraftværk Featherstone i Californiens Imperial Valley. Den udvundne væske sendes gennem en række membraner, filtre og adsorberingsmaterialer for at udvinde lithium.[93] Den almindelige udvindingsteknik består i at fordampe vand fra saltlagene. Hver udvinding tager 18 til 24 måneder.[92]
Dialyse
[redigér | rediger kildetekst]I 2015 bekendtgjorde forskere en ny havvands-udvindingsproces ved brug af dialyse. Dialysecellen bruger en superledende membran, og lithium er det eneste ion i havvandet, der kan passere igennem membranen.[92]
Omvendt osmose
[redigér | rediger kildetekst]Omvendt osmose er blevet foreslået som et alternativ, men det er ikke blevet kommercialiseret.[92]
Anvendelse
[redigér | rediger kildetekst]
Keramik og glas
[redigér | rediger kildetekst]Lithiumoxid er ofte anvendt som flux til at forarbejde silica, reducere materialets smeltepunkt og viskositet og føre til glasur med forbedrede fysiske egenskaber, heriblandt lave koefficienter for termisk udvidelse. På verdensplan er dette den enkeltstående største anvendelse af lithiumforbindelser.[94][95] Glasur indeholdende lithiumoxider anvendes til ovnfaste fade. Lithiumcarbonat (Li2CO3) anvendes generelt til dette, da det konverterer til et oxid ved opvarmning.[96]
Elektricitet og elektronik
[redigér | rediger kildetekst]Sent i det 20. århundrede blev lithium en vigtig komponent i batteri-elektrolytter og -elektroder på grund af dets høje elektrodepotentiale. På grund af dets lave atommasse har det et højt ladning- og elektricitet-til-vægt-forhold. Et typisk lithium-ion-batteri kan generere omkring 3 volt pr. celle, sammenlignet med 2,1 volt for bly-syre-batterier eller 1,5 volt for zink-carbon-batterier. Lithium-ion-batterier, som er genopladelige og har en høj energitæthed, bør ikke forveksles med lithiumbatterier, som er engangsanvendelige batterier med lithium eller dets forbindelser som anoden.[97][98] Blandt andre genopladelige batterier, der anvender lithium, er lithium-ion-polymerbatterier, lithium-jern-fosfat-batterier og nanotrådbatterier.
Smørefedt
[redigér | rediger kildetekst]Den tredjestørste anvendelse af lithium er i smørefedt. Lithiumhydroxid er en stærk base og producerer, når det opvarmes med et fedtstof, en sæbe af lithiumstearat. Lithiumsæbe kan fortykke olier og bruges til at fremstille generelt anvendeligt, høj-temperaturs smørefedt.[13][99][100]
Metallurgi
[redigér | rediger kildetekst]Lithium (i form af eksempelvis lithiumcarbonat) anvendes som et tilsætningsstof ved kontinuert støbning, hvor det øger fluiditet.[101][102] Det står for 5 % af det globale lithiumforbrug (2011).[39] Lithiumforbindelser anvendes også som tilsætningsstoffer (fluxes) til støbesand til støbejern for at reducere marmorering.[103]
Lithium (som lithiumfluorid) anvendes som tilsætningsstof til aluminiumsmeltere (Hall–Héroult-processen) for at reducere smeltetemperatur og øge elektrisk modstand,[104] hvilket står for 3 % af produktionen (2011).[39]
Når det bruges som flux til svejsning eller lodning fremmer metallisk lithium sammensmeltningen af metaller under processen[105] og eliminerer dannelsen af oxider ved at absorberer urenheder. [106]
Legeringer af metallet med aluminium, cadmium, kobber og mangan anvendes til at fremstille flydele.[107]
Silicium-nanosvejsning
[redigér | rediger kildetekst]Lithium har vist sig at være effektivt til at assistere med perfektionen af silicium-nanosvejsninger i elektroniske komponenter til elektriske batterier og andre enheder.[108]
Andre kemiske og industrielle anvendelser
[redigér | rediger kildetekst]
Pyroteknik
[redigér | rediger kildetekst]Lithiumforbindelser bruges som pyroteknisk farvestof og iltningsmidler i rødt fyrværkeri og nødblus.[13][110]
Luftrensning
[redigér | rediger kildetekst]Lithiumklorid og lithiumbromid er hygroskopiske og anvendes som tørremiddel til gasstrømme.[13] Lithiumhydroxid og lithiumperoxid er de salte, der oftest bruges i aflukkede miljøer, såsom ombort på rumskibe eller u-både, til fjernelse af kuldioxid og rensning af luften. Lithiumhydroxid absorberer kuldioxid fra luften ved at danne lithiumcarbonat og foretrækkes frem for andre alkaliske hydroxider på grund af dets lave vægt.
Lithiumperoxid (Li2O2) reagerer i tilstedeværelsen af fugt ikke kun med carbondioxid for at danne lithiumcarbonat, men udleder også oxygen.[111][112] Reaktionen sker således:
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2.
Nogle af de nævnte forbindelser, såvel som lithiumperklorat, bruges i oxygenlys, der leverer oxygen til u-både. Disse kan også indeholde små mænder bor, magnesium, aluminium, silicium, titan, mangan, og jern.[113]
Optik
[redigér | rediger kildetekst]Lithiumfluorid, dyrket kunstigt som krystal, er klart og gennemsigtigt og bruges ofte indenfor specialiseret optik, der anvender IR, UV og VUV (vakuum-UV). Ud af de fleste almindelige materialer er det et af de, der har lavest brydningsradius og længst transmissionsrækkevidde i den dybe UV.[114] Fint delt lithiumfluorid-pulver er blevet brugt til termoluminiscente radioaktivitetsdosimetre (TLD): når det udsættes for radioaktivitet, akkumulerer det krystallografiske defekter, som, når de varmes op, løser sig ved at udgive et blåligt lys, hvis intensitet er proportionel med den absorberede dosis, hvilket gør det muligt at kvantificere det.[115] Lithiumfluorid anvendes somme tider i teleskopers fokallinser.[13][116]
Lithiumniobats høje ulinearitet gør det nyttigt indenfor ikkelineær optik. Det bruges udbredt indenfor telekommunikationsprodukter såsom mobiltelefoner og optiske modulatorer til komponenter såsom resonanskrystaller. Lithium anvendes i mere end 60 % af alle mobiltelefoner.[117]
Organisk og polymerkemi
[redigér | rediger kildetekst]Organiske lithiumforbindelser anvendes bredt i produktionen af polymer og finkemikalier. Indenfor polymerindustrien, som er den dominerende forbruger af disse reagenser, er alkyllithiumforbindelser katalysatorer/initiatorer[118] i anionisk polymerisering af ufunktionaliserede alkener.[119][120][121] Indenfor produktionen af finkemikalier fungerer organiske lithiumforbindelser som stærke baser og som reagenser i dannelsen af carbon-carbon-bindinger. Organiske lithiumforbindelser forberedes fra lithiummetal og alkyliske halider.[122]
Mange andre lithiumforbindelser bruges som reagenser til at forberede organiske forbindelser. Blandt populære forbindelser er lithiumaluminiumhydrid (LiAlH4), lithiumtriethylborohydrid, n-Butyllithium og tert-butyllithium, der ofte bruges som ekstremt stærke baser kaldet superbaser.
Militære anvendelser
[redigér | rediger kildetekst]Metallisk lithium og dets komplekse hydrider, såsom lithiumaluminiumhydrid, anvendes som højenergi-tilsætningsstoffer til raketbrændstof.[15] Lithiumaluminumhydrid kan også bruges på egen hånd som fast brændstof.[123]

Mark 50-torpedoens "stored chemical energy propulsion system" (SCEPS) anvender en lille tank med svovlhexafluoridgas, som sprøjtes over en blok fast lithium. Reaktionen genererer varme og skaber damp til at drive torpedoen i et lukket Rankine-cyklus.[124]
Lithiumhydrid indeholdende lithium-6 anvendes i brintbomber, hvor det indkapsles i kernen af bomben.[125]
Nuklear
[redigér | rediger kildetekst]Lithium-6 værdsættes som et kildemateriale til tritiumproduktion og som neutronabsorber i kernefusion. Naturlig lithium indeholder omkring 7,5 % lithium-6, hvorfra store mængder lithium-6 er blevet produceret via isotopseparation til brug i atomvåben.[126] Lithium-7 er blevet interessant til brug i kølemiddel til kernereaktorer.[127]

Lithiumdeuterid var det foretrukne fusionsbrændstofl i tidlige versioner af brintbomben. Når de bombarderes af neutroner, producerer både 6Li og 7Li tritium — denne reaktion, som ikke var fuldt forstået, da brintbomber oprindeligt blev testet, var ansvarlig for den fuldstændigt overvældende effekt af prøvesprængningen Castle Bravo. Tritium fusionerer med deuterium i en fusionsreaktion, der er relativt nem at opnå. Selvom detaljerne er klassificerede, spiller lithium-6-deuterid tilsyneladende fortsat en rolle som fusionsmateriale i moderne atomvåben.[128]
Lithiumfluorid danner, når det er stærkt beriget i lithium-7-isotopen, den grundlæggende bestanddel i fluor-saltblandingen LiF-BeF2, der anvendes i atomreaktorer med flydende fluor. Lithiumfluorid er usædvanligt kemisk stabilt, og LiF-BeF2-blandinger har lavt smeltepunkt. Herudover er 7Li, Be og F blandt de få nuklider, der har så lavt neutron-tværsnit, at de ikke forgifter fissionsreaktionerne inde i kernefissionsreaktoren.[note 2][129]
I konceptualiseret (hypotetisk) kernefusions-kraftværker vil lithium blive brugt til at producere tritium i magnetisk indesluttede reaktorer ved brug af deuterium og tritium som brændstof. Naturligt forekommende tritium er ekstremt sjældent og skal produceres syntetisk ved at lægge et 'tæppe' med lithium omkring den reagerende plasma, så neutronerne fra deuterium-tritium-reaktionen i plasmaet vil fissionere lithiummet og producere mere tritium:
- 6Li + n → 4He + 3T.
Lithium bruges også som en kilde til alfapartikler eller heliumkerner. Når 7Li bombarderes med accelererede protoner, dannes 8Be, som gennemgår fission for at danne to alfapartikler. Dette, der tidligere blev kaldt at "opsplitte atomet", var den første 100 % menneskeskabte kernereaktion. Den blev produceret af Cockroft og Walton i 1932.[130][131]
I 2013 bekendtgjorde det amerikanske Government Accountability Office, at en mangel på lithium-7, der var kritisk for driften af 65 ud af 100 amerikanske kernereaktorer, “placerer deres evne til at fortsætte med at levere elektricitet i en vis risiko”. Problemet stammer fra forfaldet i den amerikanske kernekrafts infrastruktur. Det udstyr, der kræves for at separere lithium-6 fra lithium-7, er hovedsageligt efterladenskaber fra den kolde krig. USA lukkede det meste af dette maskineri ned i 1963, da man havde et enormt overskud af separeret lithium, men dette er efterfølgende blevet forbrugt igennem størstedelen af det 20. århundrede. Rapporten meldte om at det ville tage fem år og 10-12 millioner dollars at genetablere evnen til at separere lithium-6 fra lithium-7.[132]
Reaktorer, der anvender lithium-7, opvarmer vand ved højt tryk og overfører varmen gennem varmeoverførsel, der er sårbar for korrosion. Reaktorerne anvender lithium til at modvirke de korrosive effekter fra borsyre, der føjes til vandet for at absorbere overskydende neutroner.[132]
Lægemidler
[redigér | rediger kildetekst]Lithium er nyttigt til behandling af bipolar affektiv sindslidelse.[133] Lithiumsalte kan også være nyttige til relaterede diagnoser, såsom skizoaffektiv lidelse og cyklisk depression. Den aktive del af disse salte er lithiumionen Li+.[133] Der kan være forøget risiko for at udvikle Ebsteins anomali i spædbørn, der fødes af kvinder, som har taget lithium under deres graviditets første trimester.[134]
Der er også blevet forsket i lithium som en mulig behandling af Hortons hovedpine.[135]
Forholdsregler
[redigér | rediger kildetekst]| NFPA 704 |
|---|
| NFPA 704-faretegn for lithiummetal[136] |
Lithium er korrosivt og kræver særlig håndtering for at undgå kontakt med huden. Indånding af lithiumstøv eller lithiumforbindelser (som ofte er alkaliske) irriterer til at begynde med næse og hals, men større udsættelse kan forårsage opbygning af væske i lungerne, og føre til lungeødem. Selve metallet er ligeledes farligt, da kontakt med fugt producerer det kaustiske lithiumhydroxid. Lithium opbevares sikkert i ikke-reaktive forbindelser såsom nafta.[137]
Regulering
[redigér | rediger kildetekst]Nogle jurisdiktioner begrænser salget af lithiumbatterier, som er den mest tilgængelige kilde til lithium for de fleste forbrugere. Lithium kan bruges til at reducere pseudoefedrin og efedrin til metamfetamin via Birch-reduktion, som anvender alkalimetal-opløsninger opløst i vandfri ammoniak.[138][139]
Transport og forsendelse af nogle typer lithiumbatterier kan være forbudt om bord på visse typer transport (særligt fly) på grund af de fleste typer lithiumbatteriers evne til meget hurtigt at aflade, når de kortslutter, hvilket kan føre til overophedning og mulig eksplosion i en proces, der kaldes termisk runaway. De fleste lithiumbatterier til almindeligt forbrug har indbygget beskyttelse mod termisk overbelastning for at forhindre denne type hændelser eller er på anden vis designet til at begrænse kortsluttende strøm. Interne kortslutninger fra fabrikationsfejl eller fysisk skade kan dog stadig føre til spontan termisk runaway.[140][141]
Noter/Referencer
[redigér | rediger kildetekst]Noter
[redigér | rediger kildetekst]- ^ a b Bilag. Pr. USGS' definitioner kan reservebasen omfatte de dele af ressourcen som har et rimeligt potentiale for at blive økonomisk rentabelt indenfor planlægningshorisonter, der ligger fjernere end de, der antager gennemprøvet teknologi og nuværende økonomi. Reservebaserne omfatter de ressourcer, der i øjeblikket er økonomiske (reserver), marginalt økonomiske (marginalreserver) og nogle af de der i øjeblikket er subøkonomiske (subøkonomiske ressourcer)."
- ^ Beryllium og fluor forekommer begge kun som en isotop, hhv. 9Be og 19F. Disse to er, sammen med 7Li, såvel som 2H, 11B, 15N, 209Bi og O og C's stabile isotoper, de eneste nuklider (bortset fra actiniderne), der har neutron-tværsnit lave nok til at kunne fungere som centrale bestanddele i forædler i brændstof til smeltesaltreaktorer.
Referencer
[redigér | rediger kildetekst]- ^ a b Numeriske data fra: Lodders, Katharina (10. juli 2003). "Solar System Abundances and Condensation Temperatures of the Elements" (PDF). The Astrophysical Journal. The American Astronomical Society. 591 (2): 1220-1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. ISSN 0004-637X. Arkiveret fra originalen (PDF) 7. november 2015. Hentet 28. juni 2016. Graf på File:SolarSystemAbundances.jpg
- ^ Nuclear Weapon Design Arkiveret 26. december 2008 hos Wayback Machine. Federation of American Scientists (1998-10-21). fas.org
- ^ a b Schrauzer, GN (2002). "Lithium: Occurrence, dietary intakes, nutritional essentiality". Journal of the American College of Nutrition. 21 (1): 14-21. doi:10.1080/07315724.2002.10719188. PMID 11838882.
- ^ a b Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (2011). "Low-dose lithium uptake promotes longevity in humans and metazoans". European Journal of Nutrition. 50 (5): 387-9. doi:10.1007/s00394-011-0171-x. PMC 3151375. PMID 21301855.
- ^ a b c d e f g Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 0-313-33438-2.
- ^ Lide, D. R., red. (2005). CRC Handbook of Chemistry and Physics (86th udgave). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties". Encyclopedia.airliquide.com. Arkiveret fra originalen 21. juli 2011. Hentet 29. september 2010.
- ^ "Coefficients of Linear Expansion". Engineering Toolbox.
- ^ Tuoriniemi, J; Juntunen-Nurmilaukas, K; Uusvuori, J; Pentti, E; Salmela, A; Sebedash, A (2007). "Superconductivity in lithium below 0.4 millikelvin at ambient pressure". Nature. 447 (7141): 187-9. Bibcode:2007Natur.447..187T. doi:10.1038/nature05820. PMID 17495921.
- ^ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). "Superconductivity in dense lithium". Science. 298 (5596): 1213-5. Bibcode:2002Sci...298.1213S. doi:10.1126/science.1078535. PMID 12386338.
- ^ Overhauser, A. W. (1984). "Crystal Structure of Lithium at 4.2 K". Physical Review Letters. 53: 64-65. Bibcode:1984PhRvL..53...64O. doi:10.1103/PhysRevLett.53.64.
- ^ Schwarz, Ulrich (2004). "Metallic high-pressure modifications of main group elements". Zeitschrift für Kristallographie. 219 (6-2004): 376-390. Bibcode:2004ZK....219..376S. doi:10.1524/zkri.219.6.376.34637.
- ^ a b c d e f g Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (81st udgave). CRC press. ISBN 0-8493-0481-4.
- ^ "THERMO" (PDF). Arkiveret fra originalen den 21. februar 2014. Hentet 28. juni 2016.
{{cite web}}: CS1-vedligeholdelse: Uegnet url (link) - ^ a b c d e f g Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 0-19-850341-5.
- ^ a b c d Kamienski, Conrad W.; McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R. (2004). "Lithium and lithium compounds". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1209200811011309.a01.pub2.
- ^ "XXIV.—On chemical analysis by spectrum-observations". Quarterly Journal of the Chemical Society of London. 13 (3): 270. 1861. doi:10.1039/QJ8611300270.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. s. 47. ISBN 0-313-33438-2.
- ^ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1. januar 1994). "Geochemistry international". 31 (1-4): 115.
{{cite journal}}: Cite journal kræver|journal=(hjælp) - ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. s. 97-99. ISBN 0-08-022057-6.
- ^ Beckford, Floyd. "University of Lyon course online (powerpoint) slideshow". Hentet 27. juli 2008.
definitions:Slides 8–10 (Chapter 14)
(Webside ikke længere tilgængelig) - ^ Sapse, Anne-Marie & von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. s. 3-40. ISBN 0-471-54930-4.
- ^ Bretislav Friedrich (8. april 2013). "APS Physics". 6: 42.
{{cite journal}}: Cite journal kræver|journal=(hjælp) - ^ "Isotopes of Lithium". Berkeley National Laboratory, The Isotopes Project. Arkiveret fra originalen 13. maj 2008. Hentet 21. april 2008.
- ^ File:Binding energy curve - common isotopes.svg viser bindingsenergi for de stabile nuklider grafisk; kilden til datasættet vises i figurens baggrund.
- ^ Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Arkiveret fra originalen 20. december 2018. Hentet 6. juni 2008.
- ^ Asplund, M.; et al. (2006). "Lithium Isotopic Abundances in Metal-poor Halo Stars". The Astrophysical Journal. 644: 229-259. arXiv:astro-ph/0510636. Bibcode:2006ApJ...644..229A. doi:10.1086/503538.
- ^ Chaussidon, M.; Robert, F.; McKeegan, K.D. (2006). "Li and B isotopic variations in an Allende CAI: Evidence for the in situ decay of short-lived 10Be and for the possible presence of the short−lived nuclide 7Be in the early solar system" (PDF). Geochimica et Cosmochimica Acta. 70 (1): 224-245. Bibcode:2006GeCoA..70..224C. doi:10.1016/j.gca.2005.08.016. Arkiveret fra originalen (PDF) 18. juli 2010. Hentet 28. juni 2016.
- ^ Denissenkov, P. A.; Weiss, A. (2000). "Episodic lithium production by extra-mixing in red giants". Astronomy and Astrophysics. 358: L49-L52. arXiv:astro-ph/0005356. Bibcode:2000A&A...358L..49D.
- ^ Seitz, H.M.; Brey, G.P.; Lahaye, Y.; Durali, S.; Weyer, S. (2004). "Lithium isotopic signatures of peridotite xenoliths and isotopic fractionation at high temperature between olivine and pyroxenes". Chemical Geology. 212 (1-2): 163-177. doi:10.1016/j.chemgeo.2004.08.009.
- ^ Duarte, F. J (2009). Tunable Laser Applications. CRC Press. s. 330. ISBN 1-4200-6009-0.
- ^ a b Coplen, T.B.; Bohlke, J.K.; De Bievre, P.; Ding, T.; Holden, N.E.; Hopple, J.A.; Krouse, H.R.; Lamberty, A.; Peiser, H.S.; et al. (2002). "Isotope-abundance variations of selected elements (IUPAC Technical Report)". Pure and Applied Chemistry. 74 (10): 1987. doi:10.1351/pac200274101987.
- ^ Boesgaard, A. M.; Steigman, G. (1985). "Big bang nucleosynthesis – Theories and observations". Annual Review of Astronomy and Astrophysics. Palo Alto, CA. 23: 319-378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- ^ Cain, Fraser (16. august 2006). "Why Old Stars Seem to Lack Lithium".
- ^ "First Detection of Lithium from an Exploding Star". Hentet 29. juli 2015.
- ^ "Element Abundances" (PDF). Arkiveret fra originalen (PDF) 1. september 2006. Hentet 17. november 2009.
- ^ Cain, Fraser. "Brown Dwarf". Universe Today. Arkiveret fra originalen 25. februar 2011. Hentet 17. november 2009.
- ^ Reid, Neill (10. marts 2002). "L Dwarf Classification". Hentet 6. marts 2013.
- ^ a b c d e Lithium Statistics and Information, U.S. Geological Survey, 2016
- ^ "Lithium Occurrence". Institute of Ocean Energy, Saga University, Japan. Arkiveret fra originalen 2. maj 2009. Hentet 13. marts 2009.
- ^ a b c d "Some Facts about Lithium". ENC Labs. Arkiveret fra originalen 10. juli 2011. Hentet 15. oktober 2010.
- ^ "Extraction of metals from sea water". Springer Berlin Heidelberg. 1984. Arkiveret fra originalen 7. april 2020. Hentet 29. juni 2016.
- ^ Atkins, Peter (2010). Shriver & Atkins' Inorganic Chemistry (5th udgave). New York: W. H. Freeman and Company. s. 296. ISBN 0199236178.
- ^ Moores, S. (juni 2007). "Between a rock and a salt lake". Industrial Minerals. 477: 58.
- ^ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985).
- ^ Garrett, Donald (2004) Handbook of Lithium and Natural Calcium, Academic Press, cited in The Trouble with Lithium 2, Meridian International Research (2008)
- ^ Clarke, G.M. and Harben, P.W., "Lithium Availability Wall Map". Published June 2009. Nævnt på International Lithium Alliance Arkiveret 20. oktober 2012 hos Wayback Machine
- ^ a b "The Trouble with Lithium 2" (PDF). Meridian International Research. 2008. Hentet 29. september 2010.
- ^ Risen, James (13. juni 2010). "U.S. Identifies Vast Riches of Minerals in Afghanistan". The New York Times. Hentet 13. juni 2010.
- ^ Page, Jeremy; Evans, Michael (15. juni 2010). "Taleban zones mineral riches may rival Saudi Arabia says Pentagon". The Times. London. Arkiveret fra originalen 14. maj 2011. Hentet 29. juni 2016.
- ^ Chassard-Bouchaud, C; Galle, P; Escaig, F; Miyawaki, M (1984). "Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission". Comptes rendus de l'Academie des sciences. Serie III, Sciences de la vie. 299 (18): 719-24. PMID 6440674.
- ^ D'Andraba (1800). "Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège , avec quelques observations chimiques faites sur ces substances". Journal de chimie et de physique. 51: 239.
- ^ "Petalite Mineral Information". Mindat.org. Hentet 10. august 2009.
- ^ a b c d e f g "Lithium:Historical information". Hentet 10. august 2009.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. s. 124. ISBN 0-7661-3872-0. Hentet 10. august 2009.
- ^ Berzelius (1817). "Ein neues mineralisches Alkali und ein neues Metall" [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 21: 44-48. Fra p. 45: "Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto's Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden." (Hr. August Arfwedson, en ung, meget fortjenstfuld kemiker, som har arbejdet i mit laboratorie i et år, fandt under en analyse af petalit fra Utos jernmine, en alkalisk forbindelse … Vi har navngivet den lithion, for dermed at hentyde til den som den første opdagelse i mineralriget, siden de to andre første blev opdaget i organisk natur. Dets radikal vil derefter blive navngivet "lithium".)
- ^ "Johan August Arfwedson". Periodic Table Live!. Arkiveret fra originalen 7. oktober 2010. Hentet 10. august 2009.
- ^ "Johan Arfwedson". Arkiveret fra originalen 5. juni 2008. Hentet 10. august 2009.
- ^ a b c van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. Hentet 5. oktober 2010.
- ^ Clark, Jim (2005). "Compounds of the Group 1 Elements". Hentet 10. august 2009.
- ^ Gmelin, C. G. (1818). "Von dem Lithon" [On lithium]. Annalen der Physik. 59: 238-241.
p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte.
- ^ a b Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. s. 287–300. ISBN 978-3-527-30666-4.
- ^ Brande, William Thomas (1821) A Manual of Chemistry, 2nd ed. London, England: John Murray, vol. 2, pp. 57-58.
- ^ Various authors (1818). "The Quarterly journal of science and the arts" (PDF). The Quarterly Journal of Science and the Arts. Royal Institution of Great Britain. 5: 338. Hentet 5. oktober 2010.
- ^ "Timeline science and engineering". DiracDelta Science & Engineering Encyclopedia. Arkiveret fra originalen 12. oktober 2018. Hentet 18. september 2008.
- ^ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. s. 191. Hentet 8. oktober 2010.
- ^ Bunsen, R. (1855). "Darstellung des Lithiums" [Preparation of lithium]. Annalen der Chemie und Pharmacie. 94: 107-111. doi:10.1002/jlac.18550940112.
- ^ Green, Thomas (11. juni 2006). "Analysis of the Element Lithium". echeat.
- ^ Garrett, Donald E (5. april 2004). Handbook of Lithium and Natural Calcium Chloride. s. 99. ISBN 9780080472904.
- ^ a b Ober, Joyce A. (1994). "Commodity Report 1994: Lithium" (PDF). United States Geological Survey. Hentet 3. november 2010.
- ^ Deberitz, Jürgen; Boche, Gernot (2003). "Lithium und seine Verbindungen - Industrielle, medizinische und wissenschaftliche Bedeutung". Chemie in unserer Zeit. 37 (4): 258-266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard (1985). "Lithium - wie es nicht im Lehrbuch steht". Chemie in unserer Zeit. 19 (5): 167-173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. (1994). "Minerals Yearbook 2007 : Lithium" (PDF). United States Geological Survey. Hentet 3. november 2010.
- ^ Kogel, Jessica Elzea (2006). "Lithium". Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. s. 599. ISBN 978-0-87335-233-8.
- ^ McKetta, John J. (18. juli 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Hentet 29. september 2010.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 73. ISBN 978-0-08-037941-8.
- ^ Ober, Joyce A. "Lithium" (PDF). United States Geological Survey. s. 77-78. Hentet 19. august 2007.
- ^ Tarascon, J. M. (2010). "Is lithium the new gold?". Nature Chemistry. 2 (6): 510. doi:10.1038/nchem.680. PMID 20489722.
- ^ Lithium: The New California Gold Rush, Forbes magazine. 2011-10-19
- ^ a b Romero, Simon (2. februar 2009). "In Bolivia, a Tight Grip on the Next Big Resource". The New York Times.
- ^ "USGS Mineral Commodities Summaries 2009" (PDF). USGS.
- ^ Money Game Contributors (26. april 2013). "New Wyoming Lithium Deposit". Business Insider. Hentet 1. maj 2013.
{{cite web}}:|author=har et generisk navn (hjælp) - ^ "Study finds resource constraints should not be a limiting factor for large-scale EV battery production". Green Car Congress. 17. juni 2011. Hentet 17. juni 2011.
- ^ Gaines, LL. Nelson, P. (2010). "Lithium-Ion Batteries: Examining Material Demand and Recycling Issues". Argonne National Laboratory. Arkiveret fra originalen 3. august 2016. Hentet 11. juni 2016.
{{cite web}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ "University of Michigan and Ford researchers see plentiful lithium resources for electric vehicles". Green Car Congress. 3. august 2011. Hentet 11. august 2011.
- ^ "The Precious Mobile Metal". The Financialist. Credit Suisse. 9. juni 2014. Hentet 19. juni 2014.
- ^ "SQM Announces New Lithium Prices – SANTIAGO, Chile, September 30 /PRNewswire-FirstCall/". PR Newswire. 30. september 2009. Hentet 1. maj 2013.
- ^ Riseborough, Jesse. "IPad Boom Strains Lithium Supplies After Prices Triple". Bloomberg BusinessWeek. Hentet 1. maj 2013.
- ^ Parker, Ann. Mining Geothermal Resources Arkiveret 17. september 2012 hos Wayback Machine. Lawrence Livermore National Laboratory
- ^ Patel, P. (2011-11-16) Startup to Capture Lithium from Geothermal Plants Arkiveret 3. februar 2013 hos hos Archive.is. technologyreview.com
- ^ Wald, M. (2011-09-28) Start-Up in California Plans to Capture Lithium, and Market Share. The New York Times
- ^ a b c d Martin, Richard (2015-06-08). "Quest to Mine Seawater for Lithium Advances". MIT Technology Review. Hentet 2016-02-10.
- ^ Kaneya, Rui (13. april 2015). "Could Hawaii Geothermal Plant Become a Windfall for Public?". Civil Beat. Hentet 14. april 2015.
- ^ a b USGS (2011). "Lithium" (PDF). Hentet 3. november 2012.
- ^ "Worldwide demand by sector" (PDF). Arkiveret fra originalen (PDF) 7. september 2014. Hentet 30. juni 2016.
- ^ Clark, Jim (2005). "Some Compounds of the Group 1 Elements". chemguide.co.uk. Hentet 8. august 2013.
- ^ "Disposable Batteries - Choosing between Alkaline and Lithium Disposable Batteries". Batteryreview.org. Hentet 10. oktober 2013.
- ^ "Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell". Emc2.cornell.edu. Hentet 10. oktober 2013.
- ^ Totten, George E.; Westbrook, Steven R. & Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing. Vol. 1. ASTM International. s. 559. ISBN 0-8031-2096-6.
- ^ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. s. 150-152. ISBN 0-8031-2097-4.
- ^ The Theory and Practice of Mold Fluxes Used in Continuous Casting: A Compilation of Papers on Continuous Casting Fluxes Given at the 61st and 62nd Steelmaking Conference, Iron and Steel Society
- ^ Lu, Y. Q.; Zhang, G. D.; Jiang, M. F.; Liu, H. X.; Li, T. (2011). "Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting". Materials Science Forum. 675-677: 877-880. doi:10.4028/www.scientific.net/MSF.675-677.877.
- ^ "Testing 1-2-3: Eliminating Veining Defects", Modern Casting, juli 2014, arkiveret fra originalen 2. april 2015, hentet 30. juni 2016
- ^ Haupin, W (1987), Mamantov, Gleb; Marassi, Roberto (red.), "Chemical and Physical Properties of the Hall-Héroult Electrolyte", Molten Salt Chemistry: An Introduction and Selected Applications, Springer, s. 449
- ^ Garrett, Donald E. (2004-04-05). Handbook of Lithium and Natural Calcium Chloride (engelsk). Academic Press. s. 200. ISBN 9780080472904.
- ^ Prasad, N. Eswara; Gokhale, Amol; Wanhill, R. J. H. Aluminum-Lithium Alloys: Processing, Properties, and Applications (engelsk). Butterworth-Heinemann. ISBN 9780124016798.
- ^ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. s. 121–. ISBN 978-0-87170-496-2. Hentet 16. maj 2011.
- ^ Karki, Khim; Epstein, Eric; Cho, Jeong-Hyun; Jia, Zheng; Li, Teng; Picraux, S. Tom; Wang, Chunsheng; Cumings, John (2012-03-14). "Lithium-assisted electrochemical welding in silicon nanowire battery electrodes". Nano Letters. 12 (3): 1392-1397. doi:10.1021/nl204063u. ISSN 1530-6992. PMID 22339576.
- ^ Ernst-Christian, K. (2004). "Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems". Propellants, Explosives, Pyrotechnics. 29 (2): 67-80. doi:10.1002/prep.200400032.
- ^ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick Inorganic chemistry, Academic Press (2001) ISBN 0-12-352651-5, p. 1089
- ^ Mulloth, L.M. & Finn, J.E. (2005). "Air Quality Systems for Related Enclosed Spaces: Spacecraft Air". The Handbook of Environmental Chemistry. Vol. 4H. s. 383-404. doi:10.1007/b107253.
- ^ "Application of lithium chemicals for air regeneration of manned spacecraft". Lithium Corporation of America & Aerospace Medical Research Laboratories. 1965. Arkiveret fra originalen 7. oktober 2012. Hentet 30. juni 2016.
- ^ Markowitz, M. M.; Boryta, D. A.; Stewart, Harvey (1. maj 2002). "Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen - I&EC Product Research and Development (ACS Publications)". Industrial & Engineering Chemistry Product Research and Development. Pubs.acs.org. 3 (4): 321-330. doi:10.1021/i360012a016. Hentet 10. oktober 2013.
- ^ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. s. 149. ISBN 0-470-40229-6.
- ^ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy. Vol. 2001. World Scientific. 2002. s. 819. ISBN 981-238-180-5.
- ^ Sinton, William M. (1962). "Infrared Spectroscopy of Planets and Stars". Applied Optics. 1 (2): 105. Bibcode:1962ApOpt...1..105S. doi:10.1364/AO.1.000105.
- ^ "You've got the power: the evolution of batteries and the future of fuel cells" (PDF). Toshiba. Arkiveret fra originalen (PDF) 17. juli 2011. Hentet 17. maj 2009.
- ^ "Organometallics". IHS Chemicals. februar 2012.
- ^ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). "Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators". Russian Chemical Bulletin. 37 (9): 1782-1784. doi:10.1007/BF00962487.
- ^ Quirk, Roderic P.; Cheng, Pao Luo (1986). "Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium". Macromolecules. 19 (5): 1291-1294. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ^ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. s. 55. ISBN 0-12-031118-6.
- ^ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. s. 192. ISBN 0-7637-0665-5.
- ^ "LiAl-hydride" (PDF). Arkiveret fra originalen (PDF) 10. november 2006. Hentet 30. juni 2016.
- ^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). "Stored Chemical Energy Propulsion System for Underwater Applications". Journal of Energy. 7 (2): 128-133. doi:10.2514/3.62644.
- ^ Emsley, John (2011). Nature's Building Blocks.
- ^ Makhijani, Arjun & Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. s. 59-60. ISBN 0-262-63204-7.
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. s. 278. ISBN 0-309-05226-2.
- ^ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. s. 39. ISBN 0-415-07674-9.
- ^ Baesjr, C (1974). "The chemistry and thermodynamics of molten salt reactor fuels". Journal of Nuclear Materials. 51: 149-162. Bibcode:1974JNuM...51..149B. doi:10.1016/0022-3115(74)90124-X.
- ^ Agarwal, Arun (2008). Nobel Prize Winners in Physics. APH Publishing. s. 139. ISBN 81-7648-743-0.
- ^ "'Splitting the Atom': Cockcroft and Walton, 1932: 9. Rays or Particles?" Arkiveret 2. september 2012 hos Wayback Machine Department of Physics,University of Cambridge
- ^ a b Wald, Matthew L. (8. oktober 2013). "Report Says a Shortage of Nuclear Ingredient Looms". The New York Times.
- ^ a b Kean, Sam (2011). The Disappearing Spoon.
- ^ Yacobi S; Ornoy A (2008). "Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review". Isr J Psychiatry Relat Sci. 45 (2): 95-106. PMID 18982835.
- ^ Lieb, J; Zeff (1978). "Lithium treatment of chronic cluster headaches". The British Journal of Psychiatry. 133 (6): 556-558. doi:10.1192/bjp.133.6.556.
- ^ Technical data for Lithium. periodictable.com
- ^ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. s. 244-246. ISBN 978-0-8493-2523-6.
- ^ "Illinois Attorney General – Basic Understanding Of Meth". Illinoisattorneygeneral.gov. Arkiveret fra originalen 10. september 2010. Hentet 6. oktober 2010.
- ^ Harmon, Aaron R. (2006). "Methamphetamine remediation research act of 2005: Just what the doctor ordered for cleaning up methfields—or sugar pill placebo?" (PDF). North Carolina Journal of Law & Technology. 7. Arkiveret fra originalen (PDF) 1. december 2008. Hentet 5. oktober 2010.
- ^ Bro, Per & Levy, Samuel C. (1994). Battery hazards and accident prevention. New York: Plenum Press. s. 15-16. ISBN 978-0-306-44758-7.
- ^ "TSA: Safe Travel with Batteries and Devices". Tsa.gov. 1. januar 2008. Arkiveret fra originalen 4. januar 2012.
Eksterne henvisninger
[redigér | rediger kildetekst]- Lithium på The Periodic Table of Videos (University of Nottingham) (engelsk)
- International Lithium Alliance Arkiveret 17. august 2009 hos Wayback Machine (engelsk)
- USGS: Lithium-statistik og information (engelsk)
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth (engelsk)
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5. (engelsk)





